Empfehlungen zur Diagnostik und Therapie von Fettstoffwechselstörungen
- Einleitung
- Der Fettstoffwechsel
2.1 Lipide und Lipoproteine
2.2 Klassifizierung von Fettstoffwechselstörungen
- Lipidsenkende Therapie
3.1 Der Nutzen lipidsenkender Maßnahmen
3.2 Aktuelle Leitlinien und Behandlungsstrategien
3.2.1 Risikostratifizierung mittels SCORE
3.3 Risikoreduktion
3.3.1 Lebensstil
3.3.2 LDL-Cholesterinsenkende Maßnahmen
3.3.3 Maßnahmen bei Lp(a)-Erhöhung
3.3.4 Triglyzeridsenkende Maßnahmen
3.3.5 Therapie-Algorithmus
3.4 Verträglichkeit und Sicherheit lipidwirksamer Pharmakotherapie
3.4.1 Stellenwert therapeutisch erreichter sehr niedriger LDL-C-Konzentrationen
3.4.2 Statin-assoziierte Muskelschmerzen
3.5 Neuere Substanzen
3.6 Kontrolluntersuchungen unter Therapie
- Zusammenfassung
- Literatur
1. Einleitung
Aktuell liegen nationale und europäische Leitlinien für die Diagnostik und Therapie von Dyslipoproteinämien vor (1, 2). Deren wesentliche Grundlage ist die therapeutische Evidenz der LDL-Cholesterin (LDL-C)-Senkung (3, 4). Den Kern bilden vom kardiovaskulären Risiko abhängige Intensitäten lipidsenkender Maßnahmen. Hierzu gehört die auf epidemiologischer, molekularbiologischer und klinischer Evidenz beruhende Erkenntnis, dass LDL-C der relevanteste kausale pathogenetische Faktor für die Entstehung von Atherosklerose-bedingten Erkrankungen ist, vor allem der koronaren Herzkrankheit (5, 6), aber auch von Durchblutungsstörungen in den Beinen. Lipidsenkende Maßnahmen gehen mit einem Rückgang kardiovaskulärer Morbidität und Mortalität einher. Registerdaten aus Schweden zeigen beispielsweise, dass eine LDL-C-Senkung von 80 mg/dl (2 mmol/l) nach ST-Hebungsinfarkt die Gesamtmortalität innerhalb von rd. 4 Jahren um rd. 65 % senkt (7). Auch Triglyzerid(TG)-Erhöhungen sind hierfür als Risikofaktor zu berücksichtigen (8) und in besonderer Weise trifft dies auf Erhöhungen von Lipoprotein(a) (Lp(a)) zu (9).
Selbstverständlich muss immer das Gesamtrisikoprofil der Betroffenen mit allen kardiovaskulären Risikofaktoren und den möglichen Folgekrankheiten beachtet und behandelt werden.
Das Ziel dieser Ausführungen der DGFL – Lipid-Liga e. V. ist, praxisorientierte Empfehlungen zu Diagnostik und Therapie häufig auftretender Fettstoffwechselstörungen zu geben. Zu bedenken ist immer, dass es viele seltene und sehr seltene Fettstoffwechselstörungen gibt. Wenn also die übliche Diagnostik nicht schlüssig oder die etablierte Therapie nicht erfolgreich ist, sollte die Diagnose re-evaluiert werden und ggf. die Überweisung in eine spezialisierte Lipidsprechstunde erfolgen. Auch die Zusammenarbeit der verschiedenen Fachgebiete, wie Pädiatrie, Gynäkologie, Allgemeinmedizin, Innere Medizin, Diabetologie, Kardiologie, Angiologie, Neurologie und Gastroenterologie, ist elementar.
2. Der Fettstoffwechsel
2.1 Lipide und Lipoproteine
Lipide und lipidähnliche Substanzen kommen im tierischen und menschlichen Organismus ubiquitär vor. Zu ihnen gehören Cholesterin als Bestandteil von Membranen und als Vorstufe biologisch essentieller Moleküle wie Hormonen und Vitamin D sowie Triglyzeride als Energielieferant und wesentliche strukturelle Komponente des Fettgewebes. Die im wässrigen Milieu des Blutes nicht löslichen Lipide werden in den verschiedenen Lipoproteinen transportiert. Deren Komposition mit jeweils unterschiedlichen Anteilen an Cholesterin, Triglyzeriden und Proteinen ist die Grundlage ihrer Klassifikation nach dem Dichtegradienten in der Ultrazentrifuge (Abb. 1).
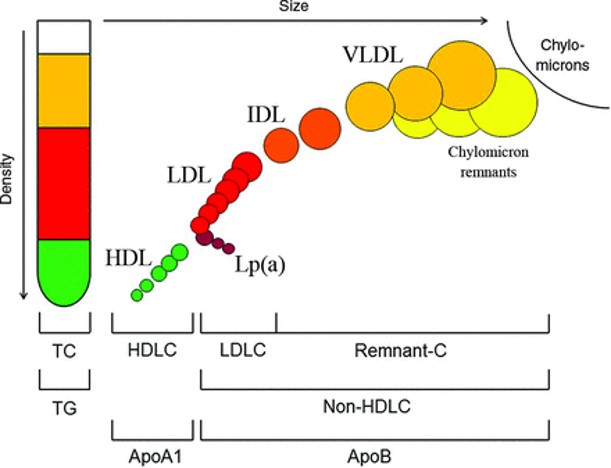
Abb. 1.: Klassifizierung der Lipoproteine im Plasma (10)
© 2018 The American Association for Clinical Chemistry
Chylomikronen sind die Transportform der mit der Nahrung aufgenommenen und im Dünndarm resorbierten Lipide.
Very Low Density Lipoproteine (VLDL) stellen die Transportform der in der Leber aus Fettsäuren und Glycerin synthetisierten Triglyzeride dar.
Intermediate Density Lipoproteine (IDL) sind – wie die Chylomikronen-Remnants –Zwischenprodukte der intravasalen Degradierung Triglyzerid-reicher VLDL durch lipolytische Enzyme. Die Abbildung veranschaulicht weiter, dass aus den IDL durch weitere Triglyzeridabspaltung die Low Density Lipoproteine (LDL) entstehen.
High Density Lipoproteine (HDL) spielen beim Transport von Cholesterin aus peripheren Geweben zur Verstoffwechselung in der Leber eine Rolle.
Die Konzentration der Plasmalipide ist abhängig von genetischen Determinanten und umgebungsbedingten Faktoren wie insbesondere dem Lebensstil, aber auch von Erkrankungen und Medikamenten.
Gesundheitsrisiken ergeben sich einerseits durch Veränderungen einer oder mehrerer Lipoproteinklassen und andererseits durch unzureichende lipidsenkende Maßnahmen bei hohem oder sehr hohem kardiovaskulärem Risiko.
2.2 Klassifizierung von Fettstoffwechselstörungen
Bei der gebräuchlichen Klassifikation von Fettstoffwechselstörungen unterscheidet man:
- Hypercholesterinämie,
- Hypertriglyzeridämie,
- Kombinierte oder gemischte Hyperlipoprotinämie bzw. Dyslipoproteinämie,
- HDL-Erniedrigung und
- Lp(a)-Hyperlipoproteinämie.
Stark erniedrigte LDL-C- und Triglyzerid-Konzentrationen können als Hypobetalipoproteinämie oder (sehr selten) Abetalipoproteinämie, erniedrigte HDL-Konzentrationen als Hypoalphalipoproteinämie klinisch relevant sein.
Nach der Ätiologie werden primäre, also genetisch bedingte, von sekundären (Tab. 1) Formen differenziert.
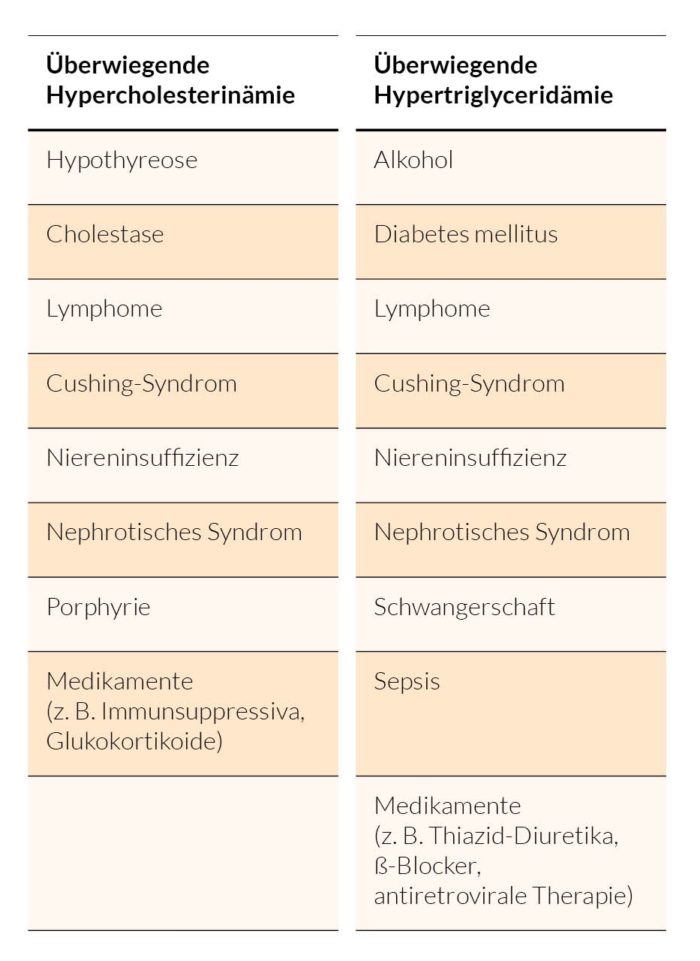
Tab. 1: Typische sekundäre Fettstoffwechselstörungen
Wegen ihrer jeweiligen Risiken herausragende Fettstoffwechselstörungen sind die Familiäre Hypercholesterinämie (FH) und das sehr massive Hypertriglyzeridämien zusammenfassende Chylomikronämie-Syndrom (11).
Die Familiäre Hypercholesterinämie (FH) ist in der heterozygoten Ausprägung mit einer Prävalenz von 250 auf 100 000 Einwohner die häufigste monogenetische Veranlagung und auch die häufigste Dyslipoproteinämie in der Praxis und geht mit hohen bis sehr hohen LDL-C-Werten einher. Die homozygote Ausprägung mit massiv hohen LDL-C-Werten ist selten (1:350.000 bis 1.000.000). Charakteristisch ist ein frühzeitiges Auftreten kardiovaskulärer Komplikationen (12). Für die Diagnostik stehen Algorithmen wie der FH-Score zur Verfügung (13). Eine genetische Diagnostik sichert nicht nur die Diagnose, sondern verbessert die Prognoseeinschätzung und die Therapieadhärenz.
Bei einer massiven Hypertriglyzeridämie (meist > 800 mg/dl/10 mmol/l), die schlecht auf therapeutische Interventionen anspricht, sollte eine genetische Diagnostik bezüglich eines monogenetisch bedingten Familiären Chylomikronämie-Syndroms (FCS) in Erwägung gezogen werden.
3. Lipidsenkende Therapie
LDL-C-senkende Maßnahmen sind bei erhöhtem kardiovaskulärem Risiko und unabhängig von der Diagnose einer Fettstoffwechselstörung Standard. Darüber hinaus kommt der Senkung erhöhter Triglyzeride bzw. von non-HDL-Cholesterin hohe Bedeutung zu.
3.1 Der Nutzen lipidsenkender Maßnahmen
Wesentliche Kategorien der Nutzenbewertung von Arzneimitteln im Arzneimittelmarktneuordnungsgesetz (AMNOG) sind neben Heilung und Verlängerung der Überlebensdauer eine langfristige Freiheit von schwerwiegenden Symptomen. Entsprechend sind die in Studien definierten Endpunkte Mortalität und Morbidität. Deren vielfache Erfüllung in randomisierten kontrollierten Studien der letzten Jahrzehnte wird im Abschnitt „Lipid-senkende Maßnahmen“ bei der jeweiligen Medikamentengruppe beschrieben. Das Ausmaß der kardiovaskulären Risikosenkung hängt in den Studien vom Ausmaß der LDL-C-Senkung und vom Ausgangsrisiko ab. Für Statine ist der Nutzen als 20 bis 25 % ige Relative Risikosenkung (RR) für ein vaskuläres Ereignis pro 1 mmol (~ 40 mg/dl) LDL-C-Senkung zusammengefasst (4).
3.2 Aktuelle Leitlinien und Behandlungsstrategien
Kern aller aktuellen Dyslipoproteinämie-Leitlinien ist die Empfehlung, die Intensität der LDL-C-senkenden Behandlung auf Basis der kardiovaskulären Risikokategorie festzulegen. Die Leitlinie der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) plädiert für die Behandlungsstrategie einer festen Statindosis (14). Dagegen verfolgt die gemeinsame Leitlinie der Europäischen Gesellschaft für Kardiologie (ESC) und der Europäischen Atherosklerosegesellschaft (EAS) (1) die Zielwertstrategie. Die Zielwertstrategie der Europäischen Leitlinie von 2019 ist nach Ansicht der DGFL – Lipid-Liga e. V. zur Sicherung der gewünschten LDL-C-Senkung und damit der Reduktion der kardiovaskulären Morbidität und Mortalität geeignet. Bei einer festen Statindosis bleibt nicht zuletzt interindividuell sehr unterschiedliche LDL-C-Absenkungen unberücksichtigt.
Die europäische ESC/EAS Leitlinie gibt vier Risikokategorien von niedrig bis sehr hoch und für diese vorgeschlagene LDL-C-Zielwerte an (Abb. 2). Erstmals wird auch eine Gruppe mit extrem hohem Risiko definiert. Die wesentlichen Inhalte der sehr umfassenden Leitlinie liegen gekürzt als Pocket-Leitlinie der Deutschen Gesellschaft für Kardiologie (DGK), die sich der Europäischen Leitlinie anschließt, in deutscher Übersetzung vor (15).
In Abbildung 2 sind die Definitionen der Risikokategorien und die jeweiligen Zielwerte für LDL-C dargestellt. Bei hohem und sehr hohem Risiko soll nicht nur der Zielwert erreicht werden, sondern der Ausgangswert von LDL-C soll um mindestens 50 % gesenkt werden. Dies ist besonders bei relativ niedrigen Ausgangswerten zu beachten.
Personen mit einer Familiären Hypercholesterinämie (FH) haben per se ein hohes Risiko. Wenn ein weiterer kardiovaskulärer Risikofaktor, z. B. eine positive Familienanamnese, vorliegt oder schon eine kardiovaskuläre Atherosklerose-Manifestation bekannt ist, dann besteht ein sehr hohes Risiko. Dies spiegelt wider, wie wichtig die frühzeitige und ausgeprägte Senkung von LDL-C bei der FH ist.
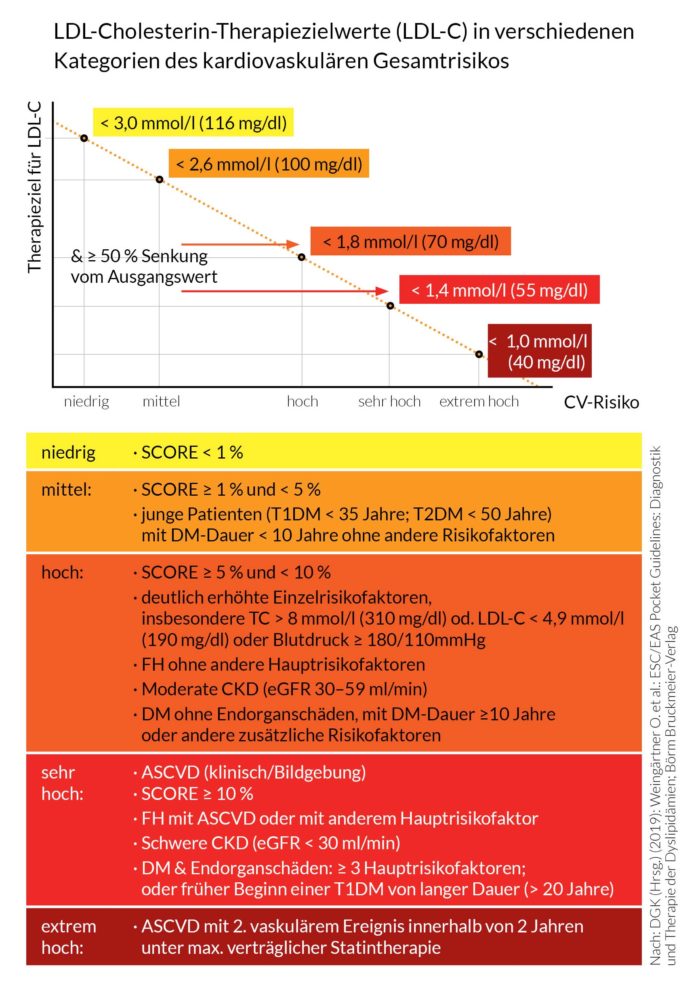
Abb. 2: ESC/EAS 2019 Risiko-basierte Behandlungsziele für die LDL-Cholesterin-
Senkung mit Berücksichtigung des von einer Familiären Hypercholesterinämie (FH)
ausgehenden Risikos (nach 15)
Wie ist es aber mit Blick auf die Empfehlungen der 2019 ESC/EAS Dyslipoproteinämie-Leitlinie um die LDL-C-Senkung bei Patienten bestellt?
Bei einem Abgleich mit der Realität zeigt sich schon bei Hochrisikopatienten ein großer Verbesserungsbedarf. Aus schwedischen Registerdaten geht hervor, dass rd. 83 % der Patienten mit Myokardinfarkt den LDL-C-Zielwert von < 55 mg/dl (< 1,4 mmol/l) und eine ≥ 50 % ige Senkung des Ausgangswertes nicht erreichen (16). Dass die Behandlungssituation hierzulande vergleichbar schlecht ist, zeigen die Ergebnisse der Da VINCI-Studie: Nur 16 % der Patienten mit sehr hohem kardiovaskulärem Risiko erreichen den LDL-Zielwert (17). Im europäischen Ländervergleich steht Deutschland sogar auf einem der hinteren Plätze (18).
3.2.1 Risikostratifizierung mittels SCORE
Für eine Zuordnung des kardiovaskulären Risikos bei Konstellationen ohne Atherosklerose-bedingte Krankheitsmanifestationen, die oft als Primärprävention klassifiziert werden, stehen diverse Algorithmen zur Verfügung. Diese verfolgen das Prinzip der Verknüpfung von Lipidwerten, Alter, Geschlecht, Blutdruck, Zigarettenrauchen und gegebenenfalls weiteren Biomarkern. Die 2019 ESC/EAS Dyslipoproteinämie-Leitlinien nehmen Bezug auf die zum SCORE (Systematic COronary Risk Evaluation)-Algorithmus führenden Daten (19). In Deutschland ist auch der PROCAM-Score gebräuchlich, der aber nicht mit den Algorithmen der ESC/EAS-Leitlinien vermischt werden darf (20). Die jeweiligen Algorithmen berücksichtigen aber nicht gesondert das Vorliegen der verschiedenen Fettstoffwechselstörungen.
MERKE: Der SCORE der ESC/EAS zur Berechnung des Risikos darf nur angewendet werden, wenn keine der in der Tabelle genannten Bedingungen, wie z.B. Niereninsuffizienz, Diabetes mellitus oder manifeste kardiovaskuläre Krankheit, vorliegt. Der SCORE kann online berechnet werden, z.B. hier. Zur Festlegung der Risikokategorie darf nur dieser SCORE und kein anderer Score verwendet werden.
3.3 Risikoreduktion
3.3.1 Lebensstil
Die Basis für die Senkung des kardiovaskulären Gesamtrisikos ist ein gesundheitsförderlicher Lebensstil bei allen Fettstoffwechselstörungen.
Hierzu gehört die Ernährung und deren Optimierung in vier wesentlichen Punkten:
- die bedarfsgerechte Kalorienzufuhr. Günstig ist zudem eine Gewichtsreduktion bei bestehendem (bauchbetontem) Übergewicht.
- die Fettmodifikation, d. h. die Reduktion der Zufuhr gesättigter Fettsäuren (FS) aus tierischen Lebensmitteln und festen Pflanzenfetten zugunsten vorwiegend mehrfach ungesättigter FS aus Fisch und Pflanzenölen wie Lein-, Walnuss- und Rapsöl,
- die Erhöhung der Ballaststoffzufuhr durch z. B. Gemüse, Vollkorn, Nüsse und Samen,
- die Reduzierung der Zufuhr schnell verfügbarer Kohlenhydrate und von Alkohol. Insbesondere bei erhöhten Triglyzeridspiegeln sind ein geringer Zuckerkonsum sowie eine Alkoholkarenz notwendig.
Ebenso zählt zu einem gesundheitsförderlichen Lebensstil regelmäßiger Sport und ein bewegter Alltag mit möglichst kurzen Sitzzeiten.
Zur Senkung des kardiovaskulären Risikos ist ferner das Nichtrauchen von großer Bedeutung.
Präventivmedizinisch sind ein möglichst früher Beginn dieser nicht-medikamentösen Maßnahmen sowie anhaltende Compliance relevant.
3.3.2 LDL-Cholesterinsenkende Maßnahmen
Das Ausmaß der durch geeignete Ernährung und körperliche Aktivität erreichbaren Senkungen von LDL-C ist variabel und oft nicht sehr ausgeprägt. Es steht eine Vielzahl von sehr gut untersuchten Medikamenten zur Senkung von LDL-C zur Verfügung. Die Optionen und ihre Effektstärken sind in Tabelle 2 zusammengestellt.
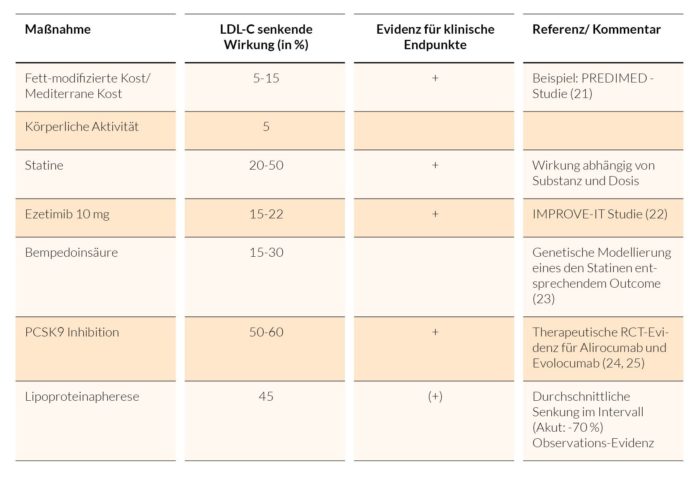
Tab. 2: Effekte LDL-C-senkender Maßnahmen
Die numerischen Angaben sind angesichts der von vielen Faktoren abhängigen Variabilität der Effekte als Anhaltswerte zu verstehen. Aktuelle Praxis ist meist ein stufenweises Vorgehen mit Eskalation der Behandlungsintensität in Abhängigkeit von Risiko-abhängigen LDL-C-Zielwerten.
Für die GKV-Erstattungsfähigkeit von PCSK9-Inhibitoren hat der G-BA eine Verordnungseinschränkung erlassen. Die Erstverordnung von PCSK9- Inhibitoren ist danach nur bei unter Standardtherapie refraktären Dyslipoproteinämie von ausgewählten Fachärzten möglich. Die GKV-Erstattung einer Apherese-Therapie basiert auf einem KV-Kommissions-Entscheid auf individuellen Antrag hin.
3.3.3 Maßnahmen bei Lp(a)-Erhöhung
Lipoprotein(a) (Lp(a)) besteht aus LDL-C, an das kovalent Apoprotein(a) gebunden ist. Die Lp(a)-Konzentration im Plasma ist genetisch determiniert, d. h. durch Lebensstilfaktoren nicht beeinflussbar. Bislang sind keine Medikamente zur Senkung erhöhter Lp(a)-Werte zugelassen. Aktuell steht allein die Lipoproteinapherese zur Verfügung. Sie ist aber nur dann indiziert, wenn der Lp(a)-Wert > 60 mg/dl (> 120 nmol/l) liegt und trotz möglichst optimaler Einstellung aller weiteren kardiovaskulären Risikofaktoren progrediente kardiovaskuläre Komplikationen nachweisbar sind. Mittels regelmäßiger Lipoproteinapherese kann der Lp(a)-Wert akut um 70 % und im längeren Verlauf um ~ 35 % gesenkt werden. Die Kostenübernahme muss bei der KV-Apheresekommission beantragt werden.
Da im Fall erhöhter Lp(a)-Werte die Aufklärung der Patient*innen besonders wichtig ist und Sensibilität braucht, hier der Hinweis auf einen Beitrag von Dr. Ulrike Schatz zum Thema „Wie kläre ich meinen Patienten mit Liporotein(a)-Erhöhung auf?“ in herzmedizin 05/2023.
3.3.4 Triglyzeridsenkende Maßnahmen
Das Vorgehen bei Triglyzerid-Erhöhungen ist von Ursache und Ausmaß der Abweichung bestimmt. Tabelle 3 fasst bei Hypertriglyzeridämie mögliche Maßnahmen zusammen.
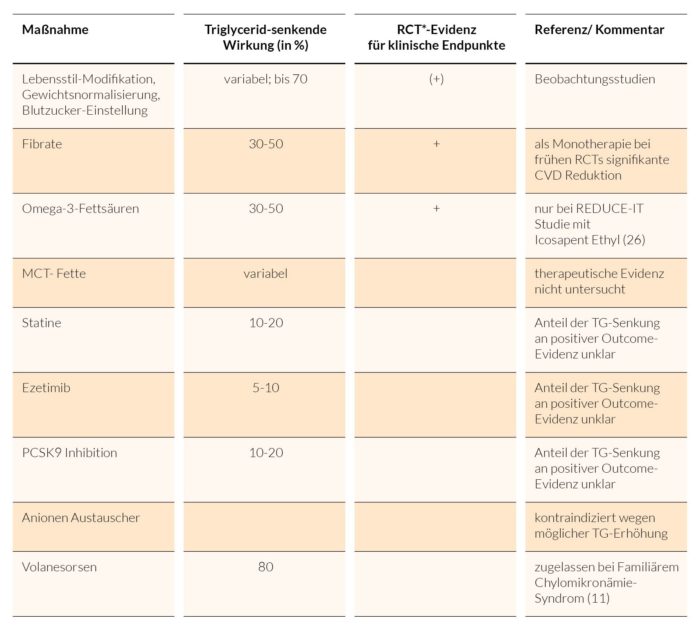
RCT = Randomized Control Trials
Tab. 3: Übersicht Triglyzerid-senkender Maßnahmen (Mod. nach (8)).
In den 2019 ESC/EAS Leitlinien (1) werden bei den Empfehlungen für Hochrisikopatienten mit Hypertriglyzeridämien (TG > 2,3 mmol/l/ > 200 mg/dl) Statine als erste Wahl zur Senkung des kardiovaskulären Risikos angeführt.
In der Primärprävention und bei Hochrisikopatienten, deren LDL-C im Zielbereich liegt, deren TG-Werte aber 2,3 mmol/l (200 mg/dl) übersteigen, kann Fenofibrat oder Bezafibrat in Kombination mit Statinen in Betracht gezogen werden.
Bei Hochrisikokonstellationen mit TG zwischen 1,7 -5,6 mmol/l (150-499 mg/dl) können langkettige Omega-3-Fettsäuren (Icosapent Ethyl 2 x 2 g/Tag) in Kombination mit Statinen erwogen werden.
Das bei ausgeprägter Hypertriglyzeridämie wirksame Antisense Oligonukleotid Volanesorsen ist bei Nachweis einer für das Familiäre Chylomikronämie- Syndrom (FCS) ursächlichen Mutation zugelassen (27).
Die Familiäre Dysbetalipoproteinämie (FDB), häufig auch als Typ III klassifiziert, gehört zu den primären Dyslipoproteinämien, die mit besonders hohen Triglyzerid-Konzentrationen einhergehen kann. Die Prävalenz liegt bei 1:10 000. Es können eruptive Xanthome und gelbe Handlinien als äußere Zeichen der FDB auftreten und das Risiko für frühzeitige kardiovaskuläre Komplikationen ist deutlich erhöht. Die FDB ist Folge eines gestörten Remnant-Stoffwechsels und anhand des Vorliegens einer Apoprotein-E2-Homozygotie objektivierbar (28).
3.3.5 Therapie-Algorithmus
Die üblicherweise eingesetzten Kombinationen synergistisch wirksamer Substanzen zur LDL-C-Senkung sind in Abbildung 3 als Stufenschema dargestellt. Die Stufen sind jeweilige Eskalationen der Behandlungsintensität bei Nichterreichen der Risiko-basierten LDL-C -Zielwerte. Empfehlungen zum gesunden Lebensstil bilden immer die Basis.
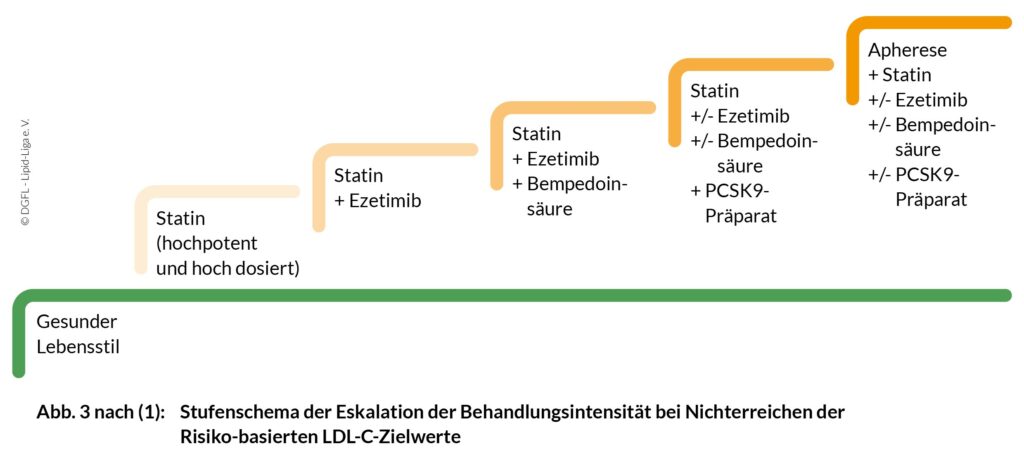
Die ersten 3 Stufen stellen die obligatorische Basistherapie dar. Hierunter kann bei den meisten Betroffenen der LDL-C-Zielwert erreicht werden.
Zur Senkung hoher Triglyzeride (TG) können Fenofibrat und Bezafibrat zusätzlich zu einem Statin mit/ohne Ezetimib eingesetzt werden. Die Nebenwirkungsrate ist hierunter kaum erhöht. Wenn im Verlauf die Lebensstilfaktoren besser umgesetzt und die TG sehr gut gesenkt sind, kann das Fibrat unter Kontrollen der TG abgesetzt werden. Sollten die TG wieder deutlich ansteigen, kann das Fibrat dann wieder angesetzt werden.
3.4 Verträglichkeit und Sicherheit lipidwirksamer Pharmakotherapie
3.4.1 Stellenwert therapeutisch erreichter sehr niedriger LDL-C-Konzentrationen
In Studien zur Sicherheit der vor allem unter Kombination mit PCSK9-Inhibitoren möglichen sehr ausgeprägten LDL-C-Senkungen, teilweise < 10 mg/dl bzw. 0,257 mmol/l haben sich keine unmittelbaren unerwünschten Arzneimittelwirkungen und keine Signale für von sehr niedrigen LDL-C-Konzentrationen ausgehende Risiken gezeigt (29). Dies ist pathophysiologisch angesichts der strikten Regulation zellulärer Cholesterinhomöostase sehr plausibel. Die hohen Anforderungen an Verträglichkeit und Sicherheit präventiver Pharmakotherapie werden von den hier besprochenen Substanzen im Allgemeinen gut erfüllt. Zu selteneren unerwünschten Arzneimittelwirkungen und zum Interaktionspotential mit anderen Medikamenten wird auf die jeweiligen Fachinformationen verwiesen.
3.4.2 Statin-assoziierte Muskelschmerzen
Zur Häufigkeit Statin-assoziierter Muskelschmerzen finden sich in randomisierten klinischen Studien Angaben um 5 %. Dagegen kann deren Häufigkeit im praktischen Alltag über 20 % betragen. Zu den Gründen dieser Divergenz gehört wahrscheinlich ein in den Praxen höherer Nocebo-Effekt. Zur Bewertung Statin-assoziierter Muskelschmerzen gehören initial die Berücksichtigung eventueller CK-Wert-Erhöhungen von über das 4-fache des oberen Normwertes und die Prüfung der Auswirkungen von Behandlungsunterbrechung und Statin-Re-Exposition (30).
3.5 Neuere Substanzen
In jüngster Zeit eingeführte LDL-C-senkende Substanzen waren Ende des Jahres 2020 die Bempedoinsäure und Anfang des Jahres 2021 Inclisiran. Ergebnisse der kardiovaskulären Outcome Studien werden für Bempedoinsäure im Jahr 2023 und für Incisiran im Jahr 2024 erwartet.
Bempedoinsäure vermindert auf einer im Vergleich zu Statinen früheren Stufe des Stoffwechselweges die Cholesterinsynthese durch Hemmung der ATP-Citrat-Lyase (ACL oder ACLY). Bempedoinsäure wird vor allem in Kombination mit einem Statin und/oder Ezetimib eingesetzt und kann eine Ergänzung oder Alternative bei Statin assoziierten Muskelschmerzen sein, weil das Prodrug Bempedoinsäure nicht in der Muskulatur aktivierbar und so nur in der Leber aktiv ist (31). Pragmatisch wird Bempedoinsäure aktuell nach Ausschöpfen der Basistherapie aus hochpotentem und hochdosiertem Statin plus Ezetimib eingesetzt, wenn noch eine relativ geringe weitere Absenkung von LDL-Cholesterin erforderlich ist, um den Zielwert zu erreichen. Vorsicht ist bei Gichtanfällen in der Anamnese geboten. Sollte Simvastatin eingesetzt werden, dürfen maximal 20 mg eingenommen werden.
Inclisiran steigert den LDL-Katabolismus durch eine siRNA-basierte Hemmung der PCSK9-Synthese. Mit dem Wirkungsmechanismus geht eine nur halbjährige Applikationsnotwendigkeit einher (32). Inclisiran wird ebenso wie die beiden PCSK9-Inhibitoren in Kombination mit einem Statin und/oder Ezetimib eingesetzt. Für die Verordnung gelten die gleichen Vorgaben des Gemeinsamen Bundesausschusses. Wenn der Zielwert relativ weit verfehlt ist, wird die Basistherapie aus hochpotentem und hochdosiertem Statin plus Ezetimib um ein PCSK9-Präparat (Inhibitor oder siRNA) ergänzt werden.
Noch nicht in Deutschland zugelassen ist ein Antikörper gegen ANGPTL3, Evinacumab. Mit einem Apo(a)-Antisense-Oligonukleotid, Pelacarsen, läuft die Endpunktstudie.
3.6 Kontrolluntersuchungen unter Therapie
Die Kontrollen von Wirkung und Verträglichkeit der lipidsenkenden Maßnahmen sind klinisch und durch Lipid- und Enzymkontrollen 6 Wochen nach Beginn sinnvoll. Bei massiv hohen Triglyzeriden ist eine frühere Kontrolle zu empfehlen. Lipoprotein(a) wird nur einmal bestimmt solange keine spezifische Therapie erfolgt. Verlaufskontrollen erfolgen dann abhängig von der individuellen Situation etwa alle 4-12 Wochen, bis der Zielwert erreicht ist. Ebenso muss den in den Fachinformationen aufgeführten möglichen Arzneimittel-Interaktionen Rechnung getragen werden. Bei klinisch stabilen Konstellationen wird in den 2019 ESC/EAS Dyslipoproteinämie-Leitlinien eine jährliche Kontrolle der Lipidwerte vorgeschlagen. Dabei sollten angesichts der möglichen Assoziation der Statintherapie mit Hyperglykämien Glucose-Kontrollen verbunden werden. Beim Einsatz retardierter Fibrate sollte die Nierenfunktion kontrolliert werden. Eine engmaschigere Überwachung ist bei CK-Erhöhungen angezeigt.
4. Zusammenfassung
Die frühzeitige Diagnostik und risikoadaptierte Therapie von Fettstoffwechselstörungen verbessert die kardiovaskuläre Morbidität und Mortalität. Die Grundlage ist immer ein angepasster Lebensstil, was insbesondere bei Hypertriglyzeridämien sehr effektiv ist. Die Art und Intensität der medikamentösen lipidsenkenden Therapie richtet sich nach der zugrundeliegenden Fettstoffwechselstörung, der Ausprägung und dem individuellen Ansprechen auf die Therapie.
Abbildung 4 fasst in Form eines vereinfachenden Behandlungspfades die Empfehlungen der DGFL – Lipid-Liga e. V. zu Diagnostik und Therapie von Fettstoffwechselstörungen zusammen.
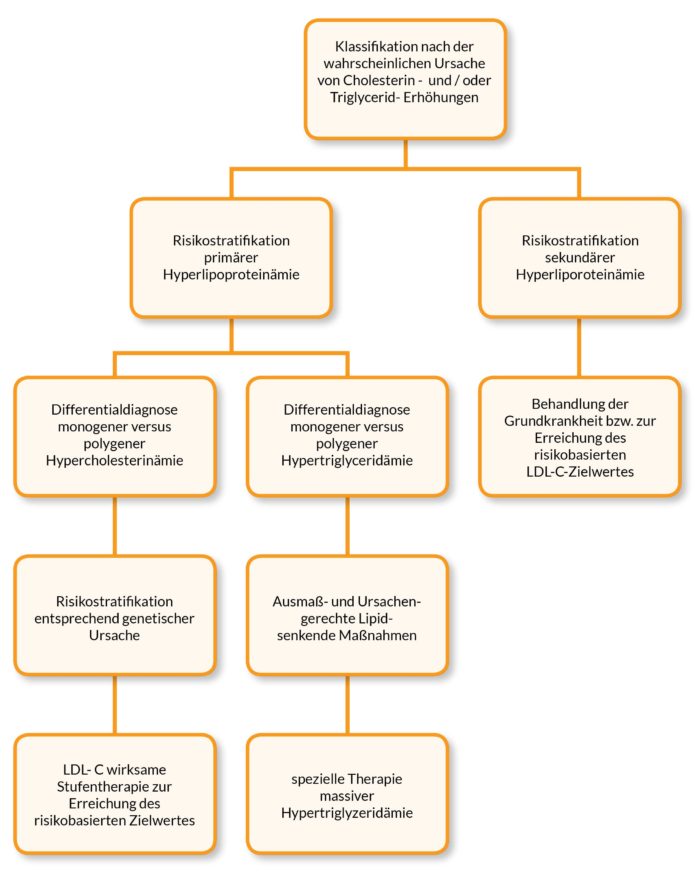
Abb. 4: Behandlungspfad zu Diagnostik und Therapie von Fettstoffwechselstörungen
5. Literatur
- Mach F, Baigent C, Catapano AL et al. (ESC Scientific Document Group): 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J (2020) Jan 1;41(1): 111-188. URL: https://pubmed.ncbi.nlm.nih.gov/31504418/ (letzter Zugriff am 17.03.2022)
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF): Nationale VersorgungsLeitlinie Chronische KHK – Langfassung, 5. Auflage. Version 1. URL: https://www.leitlinien.de/themen/khk/pdf/khk-5aufl-vers1-lang.pdf (letzter Zugriff am 17.03.2022)
- Ference BA, Ginsberg HN, Graham I, et al.: Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J (2017) Aug 21; 38 (32): 2459-2472
- Borén J, Chapman MJ, Krauss RM, et al.: Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J (2020) Jun 21; 41 (24): 2313-2330
- Nabel EG, Braunwald E: A tale of coronary artery disease and myocardial infarction. N Engl J Med (2012) Jan 5; 366 (1): 54-63
- Fulcher J, O’Connell R, Voysey M et al., Cholesterol Treatment Trialists‘ (CTT) Collaboration, Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet (2015) Apr 11; 385 (9976): 1397-405
- Schubert J, Lindahl B, Melhus H et al: Low-density lipoprotein cholesterol reduction and statin intensity inmyocardial infarction patients andmajor adverse outcomes: a Swedish nationwide cohort study. Eur Heart J (2021) 42; 243-252
- Parhofer KG, Laufs U: The Diagnosis and Treatment of Hypertriglyceridemia. Dtsch Arztebl Int (2019) Dec 6; 116 (49): 825-832
- Langsted A, Kamstrup PR, Nordestgaard BG: High lipoprotein(a) and high risk of mortality. Eur Heart J (2019) Sep 1; 40 (33): 2760-2770
- Langlois MR, Chapman MJ, Cobbaert C et al., European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) Joint Consensus Initiative: Quantifying Atherogenic Lipoproteins: Current and Future Challenges in the Era of Personalized Medicine and Very Low Concentrations of LDL Cholesterol. A Consensus Statement from EAS and EFLM. Clin Chem (2018) Jul; 64 (7): 1006-1033. URL: https://academic.oup.com/clinchem/article/64/7/1006/5608948 (letzter Zugriff am 18.03.2022)
- Baass A, Paquette M, Bernard S et al. Familial chylomicronemia syndrome: an under-recognized cause of severe hypertriglyceridaemia. J Intern Med (2020) Apr; 287 (4): 340-348
- Klose G, Laufs U, März W, Windler E: Familial hypercholesterolemia: developments in diagnosis and treatment. Dtsch Arztebl Int (2014) Aug 4; 111 (31-32): 523-9
- Fh-Score: URL https://www.fhscore.eu/?gclid=EAIaIQobChMIob6C7oDQ9gIVxuzVCh3-TQE1EAAYASAAEgKeB_D_BwE#/landing
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. (DEGAM): Hausärztliche Risikoberatung zur kardiovaskulären Prävention. S3-Leitlinie. URL: https://www.degam.de/files/Inhalte/Leitlinien-Inhalte/Dokumente/DEGAM-S3-Leitlinien/053-024_Risikoberatung%20kardiovaskul.%20Praevention/053-024l_Hausa%CC%88rztliche_Risikoberatung_kardivaskula%CC%88re_Praevention_29-08-2018.pdf (letzter Zugriff am 18.03.2022)
- Deutsche Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e.V. (2020): ESC/EAS Pocket Guidelines. Diagnostik und Therapie der Dyslipidämien. Version 2019. Börm Bruckmeier Verlag GmbH, Grünwald URL: https://leitlinien.dgk.org/2020/pocket-leitlinie-diagnostik-und-therapie-der-dyslipidaemien-version-2019/ (letzter Zugriff am 18.03.2022)
- Allahyari A, Jernberg T, Hagström E et al: Application of the 2019 ESC/EAS dyslipidaemia guidelines to nationwide data of patients with a recentmyocardial infarction: a simulation study. Eur Heart J (2020) 41: 3900-3909
- Gouni-Berthold et al Clin Res Cardiol (2021): Lipid lowering therapy in primary and secondary prevention across Europe: are LDL-C goals achieved in Germany? Results from the DA VINCI study. Abstract-URL: https://dgk.org/kongress_programme/jt2021/aP1105.html
- Ray K, Molemans B, Schoonen W M: EU-Wide Cross-Sectional Observational Study of Lipid-Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study: Eur J Prev Cardiol (2021) 28: 1279-1289
- SCORE-European High Risk Chart. URL: https://www.escardio.org/static-file/Escardio/Subspecialty/EACPR/Documents/score-charts.pdf (letzter Zugriff am 18.03.2022)
- Assmann Stiftung für Prävention: PROCAM-Gesundheitstest. URL: https://www.assmann-stiftung.de/procam-tests/ (letzter Zugriff am 18.03.2022)
- Estruch R, Ros E, Salas-Salvadó J et al., PREDIMED Study Investigators: Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med (2018) Jun 21; 378 (25): e34.
- Cannon CP, Blazing MA, Giugliano RP et al: Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med (2015) June 18; 372 (25): 2387-2397
- Ference BA, Ray KK, Catapano AL et al.: Mendelian Randomization Study of ACLY and Cardiovascular Disease. N Engl J Med (2019) Mar 14; 380 (11): 1033-1042. doi: 10.1056/NEJMoa1806747. PMID: 30865797.
- Robinson JG, Farnier M, Krempf M et al.: Efficacy and Safety of Alirocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med (2015) April 16; 372 (16): 1489-1499
- Sabatine MS, Giugliano RP, Keech AC et al.: Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med (2017) May 4; 376 (18): 1713-1722
- Yokoyama M, Origasa H, Matsuzaki M et al: Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. The Lancet (2007) March 31: 369 (9567): 1090-1098. DOI: https://doi.org/10.1016/S0140-6736(07)60527-3+
- Gelbe Liste. Pharmaindex: URL: https://www.gelbe-liste.de/wirkstoffe/Volanesorsen_55843 (letzter Zugriff am 23.03.2022
- März W, Grammer T, Delgado D et al.: Angeborene Störungen im Lipoproteinstoffwechsel. Herz (2017) 42: 449–458
- Giugliano RP, Pedersen TR, Park JG et al., FOURIER Investigators: Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet (2017) Oct 28; 390 (10106): 1962-1971
- Laufs U, Scharnagl H, Halle M, Windler E, Endres M, März W: Treatment options for statin-associated muscle symptoms. Dtsch Arztebl Int (2015); 112: 748–55. DOI: 10.3238/arztebl.2015.0748
- Niman S et al.: A Review of the Efficacy and Tolerability of Bempedoic Acid in the Treatment of Hypercholesterolemia. A J Cardiovasc Drugs (2020) Dec; 20 (6): 535-548
- Wright RS, Ray KK, Raal FJ et al., ORION Phase III Investigators: Pooled Patient-Level Analysis of Inclisiran Trials in Patients With Familial Hypercholesterolemia or Atherosclerosis. J Am Coll Cardiol (2021) Mar 9; 77 (9): 1182-1193
